
本文将通知您:
国际新药临床研讨的现状如何?
从政策层面看,临床实验管理的改良有哪些要点?
承受境外临床实验数据的举措,为国际企业带来了什么机遇?
国际创新药全球开发战略的次要应战是什么?
基于产品开发和团队的角度,什么样的新药企业能跑出来?
一、背景简介
临床研讨是新药开发中最重要的组成局部和关键环节。据统计, 临床开发费用占药品总开发费用的60%以上。
在高特佳投资此前一些专题研讨中,讨论过关于药品临床实验成功率: 根据来自2006年至2015年十年间1103个公司的7455个项目的临床和审评成功率数据统计Ⅰ期临床的成功率约60%,Ⅱ期成功率约30%,Ⅲ期的成功率约58%; Ⅱ期临床成功率最低,新药从该阶段进入了疗效的考验,Ⅱ期失败缘由次要集中在:疗效差占48%及平安性成绩占25%;Ⅲ期临床失败缘由中疗效差占55%,平安性成绩占14%。
同时我们也理解到:不同顺应症的药品开发成功率有较大的不同;不同类别的药品,如小分子化药、生物药(单抗、蛋白类、疫苗等)、生物相似物的开发成功率辨别为小于10%、10%至15%、46%,非肿瘤单抗成功率简直为肿瘤单抗的一倍;生物标志物将药品开发成功率进步了1至2倍。
由此可以了解,为何之前VC机构在Ⅰ期临床成功前进出的比例较多,为何在Ⅲ期临床开端和商业化加入的案例绝对增加。但是, 新药投资行业也是在不时演进的进程中,一些机构凭仗在创投圈的深耕以及丰厚的行业经历,在这个范畴中做到越来越专业。
以下案例简析可有利于相关方面的了解:
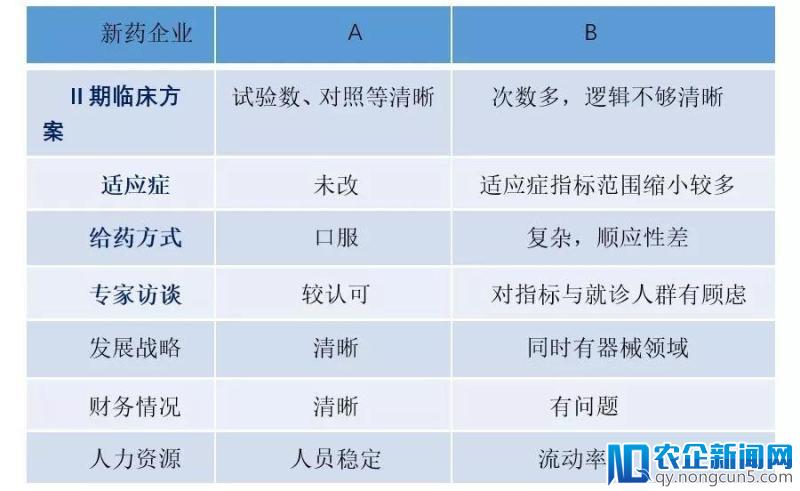
1、新药企业A与B
团队背景:相近
顺应症成功率:类似
产品类别:均为NME,first-in-class,均未用生物标志物
开发阶段:均要进入Ⅲ期临床
2、某新型开发形式的创新药初创企业
引进开发失败的药物,用生物标志物的办法,试图在某缺乏药物医治的严重顺应症上获得成功。在项目剖析进程中我们发现临床数据的印证存在成绩,前期失掉了对方的证明。
3、对某抗体药企业临床Ⅰ期后果和Ⅲ期停顿的跟踪和剖析,支持了投决决策。
二、临床实验简介
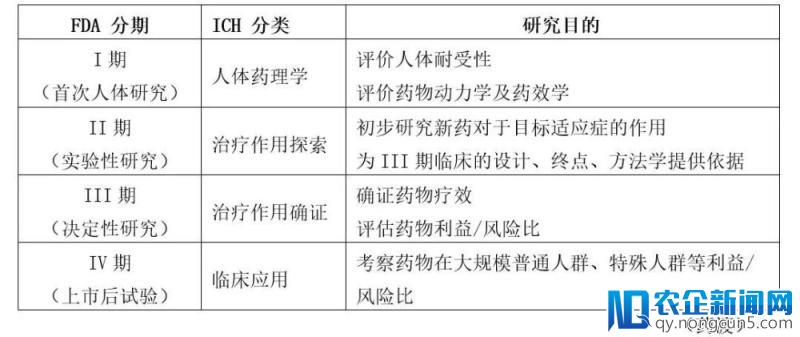
需求阐明的是,目前中国还是允许用大批件,即在一个批件上面可以设计很多临床,而且其中Ⅰ、Ⅱ,甚至Ⅲ期的顺序也不需求那么明晰,由于不像在美国,在做各期临床前需向FDA去沟通,阐明有足够的数据来确认可以推进。
此前信达的PD-1单抗拿到国际临床批件一年半内申报上市惹起热议,这外面除了其他一些要素,与前述所说的缘由有关系。
三、国际新药临床研讨现状
(一)参与者生态
1、 国际临床研讨者和机构资源存在数量和经历上的双重缺乏: 国际根本没有针对临床研讨而设计的专业来培育临床研讨医生,而医院通常是依据临床医治的需求配置医院医生,没有额定招聘临床研讨医生。国际Ⅰ期临床实验机构,尤其是较好的Ⅰ期临床研讨机构数量少。
2、相当长时期以来外企的项目以标准的流程体系、较高的创新水平吸引着国际临床研讨者的参与,国际企业面临着与外企停止研讨者和医院资源的抢夺。
3、 近年来国际一些 新药研发 项目走向国际,而参与其中的研讨者就有能够在诸如ASCO等高程度的国际会议上宣布其最新的研讨报告。 目前研讨者在接新药项目时都会细心评价项目的技术含量和有能够的临床价值、患者获益,由此初步构成一种新药临床研讨的良性循环。由此可见,作为新药开发企业,努力进步研发质量,添加产品的创新度,完成真正的临床价值是最重要的任务。
4、我们常常理解到药品临床实验入组的速度不及预期的实践状况,尤其是新药晚期阶段的临床研讨。 一些大型的三甲医院的确集中了大少数高程度的研讨者,但一些面临招募压力的项目已把招募的对象转向二级医院。 按理说中国患者总量丰厚,但近年来研讨项目也呈现“井喷”景象;同时受试者与申办方、研讨者之间的信息不对称也是招募难的一个缘由。因而需求具有公信力的平台或专业的机构,让更多患者从威望或专业的渠道获取临床实验的信息,处理信息不对称成绩。
5、 有的国际多中心临床研讨项目会遇到因伦理审查工夫的拖延招致中国无法参与研讨的状况。
(二)重要改良政策
去年中共地方办公厅、国务院办公厅印发的《关于深化审评审批制度变革鼓舞药品医疗器械创新的意见》,其中第一局部就是关于变革临床实验管理,相关要求有:
临床实验机构资历认定实行备案管理。
支持临床实验机构和人员展开临床实验。支持医疗机构、医学研讨机构、医药初等学校展开临床实验,将临床实验条件和才能评价归入医疗机构等级评审……鼓舞临床医生参与药品医疗器械技术创新活动,对临床实验研讨者退职务提升、职称提升等方面与临床医生厚此薄彼。允许境外企业和科研机构在我国依法同步展开新药临床实验。
完善伦理委员会机制。进步伦理审查效率……在我国境内展开多中心临床实验的,经临床实验组长单位伦理审查后,其他成员单位应认可组长单位的审查结论,不再反复审查。国度临床医学研讨中心及承当国度科技严重专项和国度重点研发方案支持项目的临床实验机构,应整合资源树立一致的伦理审查平台,逐渐推进伦理审查互认。
优化临床实验审批顺序。树立完善注册请求人与审评机构的沟通交流机制。受理药物临床实验和需审批的医疗器械临床实验请求前,审评机构应与注册请求人停止会议沟通,提出意见建议。受理临床实验请求后一活期限内,食品药品监管部门未给出否认或质疑意见即视为赞同,注册请求人可依照提交的方案展开临床实验……
承受境外临床实验数据。在境外多中心获得的临床实验数据,契合中国药品医疗器械注册相关要求的,可用于在中国申报注册请求。对在中国初次请求上市的药品医疗器械,注册请求人应提供能否存在人种差别的临床实验数据。
支持拓展性临床实验。对正在展开临床实验的用于医治严重危及生命且尚无无效医治手腕疾病的药品医疗器械,经初步察看能够获益,契合伦理要求的,经知情赞同后可在展开临床实验的机构内用于其他患者,其平安性数据可用于注册请求。
严肃查处数据造假行为。
CFDA在2017年12月28日发布了《总局关于鼓舞药品创新实行优先审评审批的意见》,其中优先审评的局部内容摘录如下:
具有分明临床价值,契合下列情形之一的药品注册请求:
1.未在中国境内外上市销售的创新药注册请求。
2.转移到中国境内消费的创新药注册请求。
3.运用先进制剂技术、创新医治手腕、具有分明医治优势的药品注册请求。
4.请求人在美国、欧盟同步请求并获准展开药物临床实验的新药临床实验请求;在中国境内用同终身产线消费并在美国、欧盟药品审批机构同步请求上市且经过了其现场反省的药品的注册请求。
防治下列疾病且具有分明临床优势的药品注册请求:
1、艾滋病;2、肺结核;3、病毒性肝炎;4、稀有病;5、恶性肿瘤;6、儿童用药品;7、老年人特有和多发的疾病。
其他:临床急需、市场充足的药品注册请求。详细种类名单由国度卫生计生委和工业和信息化部提出,食品药品监管总局药品审评中心(以下简称药审中心)组织相关部门和专家论证后确定。
(三)机遇与应战
1、机遇
临床实验机构资历认定实行备案管理;支持临床实验机构和人员展开临床实验的相关举措;完善伦理委员会机制,进步伦理审查效率等将使得临床实验机构资源有所添加,效率提升。
优化临床实验审批顺序,“一活期限内未否认或质疑即可视为赞同”,使得临床研讨的评价进度有了一定的保证。
承受境外临床实验数据的举措(详见2017年10月20日发布的《承受境外临床实验数据的技术要求》),这关于国际企业来说的机遇在于假如有很强的国际协作才能,又可以深化理解中国患者群,拿出有压服力的方案,并在国际临床研讨者和机构资源紧缺的条件下仍能扎实地推进临床研讨,这些综合才能才干够吸引国外优质企业拿出他们的重要产品来协作。
详细来看,异样是项目引进,区别在于有的企业拿到的是外企淘汰或中止开发的种类,而有的企业拿到的是对方依然在国外市场开发推进中的first-in-class种类。
2、应战
允许境外企业和科研机构在我国依法同步展开新药临床实验(而原先的规则是已在境外注册的药品或许已进入II期或许III期临床实验的药物),以及后面提到的承受境外临床实验数据。有利于国外新药在国际的开发、上市进程,关于中国广阔患者来说是坏事,关于国际药企不得不说是一场不小的应战,将会愈加促进中国新药企业的优胜劣汰。
CFDA在2017年12月发布的《总局关于鼓舞药品创新实行优先审评审批的意见》,关键点在于强调临床价值,鼓舞原始创新,鼓舞与国外停顿同步的创新药。这外面机遇与应战并存,换句话说由于国际药品审评变革迅猛,国际新药全球同步注册的开展会放慢,MRCT将会逐渐成为国际优秀企业的选择。
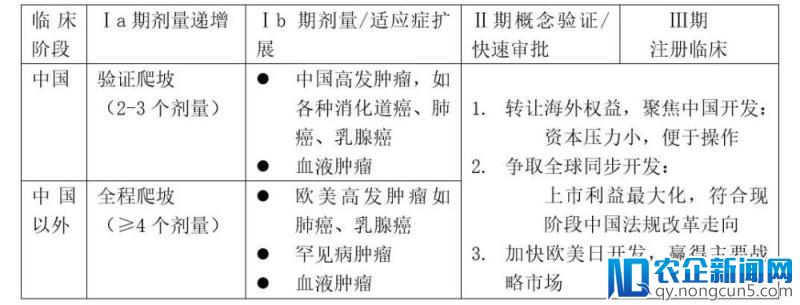
为什么做MRCT?比方肿瘤中国市场相比还是偏小,由于医保等缘由,80%的市场在欧美;应用其他国度的病人资源,其他国度病人做了数据后关于将来国际市场推行药品会有很多便当。康弘药业计划去欧美做康柏西普的临床,产品国际上市多年,阐明对其疗效平安性有决心。
而中国创新药全球开发战略的次要应战在于:
1)资金:例如欧美肿瘤临床, CRO 、实验加检测费用一个病人达10万美金。
2)MRCT运作的复杂性:比方药品的消费供给,消费阶段就要思索要在哪些国度展开临床,各国的GMP有所不同,中国参加ICH后这方面会渐渐改善;各地医疗保险的不同会招致设计方案时对照药、结合用药的药品的不同。
3)疗效的评价:比方有各种缘由可形成药效在人种上的差别;各国某病情严重水平不同,形成医治效果会有不同;临床起点数据、数据的质量等等都得仔细思索。
但是各种困难不会阻挠优质企业停止全球开发的趋向,就像仿制药中一局部企业还在犹疑要不要做分歧性评价的时分,多数抢先企业曾经完成了首批种类的分歧性评价任务。那么何时开端MRCT等成绩,以下以肿瘤顺应症为例做一些讨论:
四、小结
近期创新药范畴的报告中投研已做了影响要素(PEST模型),及将来开展途径的剖析 ,比方:Me-too类创新药定位于中国市场,能带来确定性较高和较快的报答期,但也面临着市场竞争较大;first/best-in-class类创新药定位于全球,风险更大和周期更长,但为国际认可,能够的收益更高。
关于大少数企业,创新药研发从Me-too类创新药着手;多数综合实力较强的企业会选择同时向两个方面开展,可以更好提升公司价值。
那么详细到什么样的新药企业能跑出来,关键还是什么样的人在做一些什么样的事情,即团队和产品开发。
以下结合本文所围绕的临床研讨角度,对团队和产品开发停止一些总结:
(一)产品开发:
1、投资人常常问的项目优势、市场多大等,这在新药开发中有专门的环节,即TPP(目的产品特性),处理的就是目的战略成绩,需经过疾病和医治情况,市场现有产品的缺乏,以及在研产品的特点与市场定位等剖析后确定。而在项目剖析或许尽调中投资机构会发现有相当数量的新药企业恰恰没有可以很好做到这一点,对所开发种类的定位模糊不清。
2、经过战术CDP(临床开发方案)的制定来达成目的战略,即能否有以终为始的临床研讨思绪。此外,免疫肿瘤医治中还有更多的不可控性和不可预知性,需求更精密的设计。
3、产品研发的最终目的是为了获批上市,因而结合RSDP(注册战略)将使得开发思绪愈加明晰,大大提升开发效率。例如FDA的审评,在IND最后阶段或临床Ⅰ期继续递交、增强沟通,争取快审通道(Fast Track)。在临床Ⅰ期、Ⅱ期阶段若优于现有医治,可以请求打破性医治资历。在临床Ⅲ期阶段应用替代起点或两头临床起点目标有条件同意,可请求减速审评(Accelerated Approval)。在NDA阶段还有优先评审(Priority Review)。
(二)团队:
1、理解团队的差距,如开创人、中心团队关于新药开发中最重要的组成局部和关键环节临床研讨的看法,设计最后的TPP能否合理。关于自研的种类,在结合RSDP,执行CDP的时分,可以很好的掌新生的改变世界的企业将会诞生,从而更好的服务整个人类世界,走向更高科技的智能化生活。握转让或自行开发的节拍。
2、引进优质项目异样也是团队实力的表现。如前所述,需求深化理解某疾病及患者群状况,拿出有压服力的方案,并在国际临床研讨者和机构资源紧缺的条件下仍能扎实地推进临床研讨,这些综合实力才干够吸引国外优质企业拿出他们的重要产品来协作。
3、正如我们之前常常提及的,假如说大分子药物的消费、质控是拉开企业差距的环节之一,那么临床实验更是表现企业种类开发实力的重要方面,因而中心团队中的相关一流的人才必不可少。
据火石近期统计,2010年至2017年生物医药公司的风投资金加入记载,70%的资金加入集中在IPO阶段,并购和股权转让共占30%,即投资一家生物医药公司,大约率是在IPO阶段才干将资金收益发出。在新药投资体系较为成熟的美国,关于产品线和团队的剖析曾经到达了相当深化的水平。在中国这集体系正在构成进程中,考验投资人的火眼金睛。

2018年3月23日,亿欧将在广州举行
GIIS 2018第三届医药将来首领峰会
,就跨界玩家、创新药研发、产业基金、CRO、两票制、处方外流、医院和药店管理运营等抢手话题,携手业界大咖停止交流分享,以期在认知层和办法论给行业带来新考虑、新启示。
